Xử lý khí thải là công việc bắt buộc phải làm đối với các công ty nhà máy, xí nghiệp, nhằm bảo vệ môi trường sống. Hiện nay, xử lý khí thải bằng phương pháp hấp thụ được áp dụng phổ biến, giúp làm sạch khí thải hiệu quả. Vậy cách tính toán trong xử lý khí thải bằng phương pháp này ra sao, mời bạn cùng theo dõi dưới đây.

⇒ Xem thêm: Tìm hiểu về xử lý khí thải bằng phương pháp hấp thụ
1. Cân bằng pha trong hệ khí – lỏng
Trong quá trình hấp thụ, xảy ra sự tương tác giữa chất khí với dung dịch có chứa chất có khả năng tác dụng với chất khí. Đôi khi chất khí hòa tan tác dụng trực tiếp với dung môi. Số liệu về sự hòa tan của các khí trong chất lỏng có trong các sổ tay chuyên dùng.
Khi nồng độ khí hòa tan bé, nhiệt độ và áp suất xa các điểm tới hạn thì sự cân bằng hệ lỏng – khí có thể xác định theo định luật Henry:
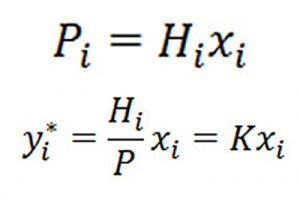
Trong đó:
Pi : áp suất riêng phần của cấu tử i trong pha khí lúc cân bằng;
Hi : hằng số Henry của cấu tử i (có thứ nguyên áp suất);
xi : tỷ lệ phân mol của cấu tử i trong pha lỏng;
yi*: tỷ lệ phân mol của cấu tử i trong pha khí lúc cân bằng (có dấu *);
P : áp suất tổng của hệ;
K = Hi/P : hệ số không thứ nguyên.
Trong trường hợp chất khí tham gia phản ứng hóa học trong dung dịch thì định luật Henry phải áp dụng không phải cho nồng độ tồng của khí hòa tan mà cho nồng độ của khí chưa phản ứng.
2. Quy luật động học
Đối với hấp thụ vật lý
Trong hấp thụ vật lý, sự vận chuyển các chất trong phạm vi từng pha được xác định bằng các phương pháp cấp khối:
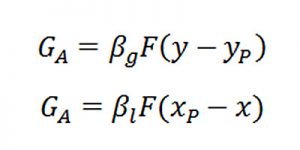
Còn sự vận chuyển các chất từ pha này qua pha khác thì theo các phương trình truyền khối sau:
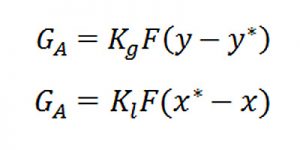
Quan hệ giữa các hệ số truyền khối (K) và các hệ số cấp khối (𝛽) như sau:
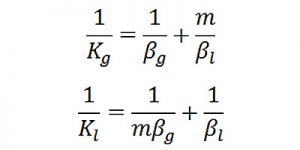
Trong đó:
GA : lượng vật chất truyền vận, Kmol/h ;
𝛽g, 𝛽l : hệ số cấp khối trong pha khí và pha lỏng tương ứng, m/h ;
F : bề mặt tiếp xúc pha, m2 ;
y, x (Kmol/m3): nồng độ của cấu tử được vận chuyển trong pha khí và pha lỏng.
Độ hòa tan một số khí trong nước:
| TT | Chất khí | Nhiệt độ, 0C | |||||||
| 0 | 10 | 15 | 20 | 30 | 40 | 50 | 60 | ||
| 1 | N2O(A) | 1,05(50 | 0.88 | 0,74 | 0,63 | – | – | – | – |
| 2 | NO (A) | 0,074 | 9,057 | 0,051 | 0,047 | 0,040 | 0,035 | 0,032 | 0,030 |
| 3 | NH3(A) | 1299 | 910 | 801 | 709 | 593(280 | – | – | – |
| 4 | HCl(S) | 507 | 474 | 458 | 442 | 411 | 386 | 362 | 339 |
| 5 | SO2(S) | 79,8 | 56,6 | 47,3 | 39,4 | 27,2 | 18,8 | – | – |
| 6 | H2S(A) | 4,62 | 3,36 | 2,91 | 2,55 | 2,01 | 1,64 | 1,38 | 1,18 |
| 7 | CO2(A) | 1,713 | 1,194 | 1,019 | 0,878 | 0,665 | 0,530 | 0,436 | 0,359 |
| 8 | CO (A) | 0,035 | 0,028 | 0,025 | 0,023 | 0,020 | 0,018 | 0,016 | 0,015 |
| 9 | Cl2 (S) | 4,61 | 3,08 | 2,63 | 2,26 | 1,77 | 1,41 | 1,20 | 1,01 |
Ghi chú :
(A): Chỉ số ml khí nằm cân bằng với nước mà áp suất riêng phần của khí luôn luôn
không đổi và bằng 760 mmHg
(S) : Chỉ số ml khí ở 00C, 760 mmHg hòa tan trong 1 ml nước ở nhiệt độ chỉ định và ở tổng áp suất khí và hơi nước là 760 mmHg
yp, xp : nồng độ của cấu tử được chuyển vận tại ranh giới phân pha giữa pha khí và pha lỏng, Kmol/m3
y*: nồng độ của cấu tử trong pha khí cân bằng với nồng độ của khí, Kmol/m3
x*: nồng độ của cấu tử trong pha lỏng cân bằng với nồng độ của khí, Kmol/m3
m : hằng số cân bằng pha (yp = mxp)
Kg, Kl : hệ số truyền khối tính theo nồng độ trong pha khí và pha lỏng, m/h.
Trong các hệ có độ hòa tan cao thì m ≈ 0, do đó Kg ≈ 𝛽g, tức là trong hệ lỏng – khí như vậy trở lực của quá trình truyền khối tập trung tại pha khí.
Trong các hệ khí ít hòa tan trong chất lỏng thì m có giá trị rất lớn, do đó Kl ≈ 𝛽l, nghĩa là trở lực truyền khối tập trung tại pha lỏng.
Độ hòa tan của một số khí trong nước ở áp suất thường (cm3 khí/lít nước):
| TT | Chất khí | Nhiệt độ, 0C | |||
| 0 | 20 | 40 | 60 | ||
| 1 | Axêtylen | 1.730 | 1.030 | – | – |
| 2 | NH3 | 1.300.000 | 710.000 | – | – |
| 3 | SO2 | 800 | 395 | 190 | – |
| 4 | CO2 | 1.713 | 878 | 530 | 360 |
| 5 | CO | 35,4 | 23,2 | 17,8 | 14,9 |
| 6 | H2S | 4.670 | 2.580 | 1.660 | 1.190 |
| 7 | Cl2 | – | 2.260 | 1485 | – |
| 8 | HCl | 507.000 | 442.000 | 386.000 | 339.000 |
Vì trị số của 𝛽g lớn rất nhiều so với 𝛽l nên quá trình hấp thụ xảy ra rất nhanh trong hệ có trở lực khuếch tán truyền khối trong pha khí và như vậy thiết bị cho trường hợp này sẽ có kích thước bé.
Trong quá trình hấp thụ có kèm phản ứng hóa học trong pha lỏng thì gradient nồng độ ở bề mặt phân pha tăng lên so với trường hợp hấp thụ vật lý, hoặc là do tăng động lực khi các hệ số cấp khối trong pha lỏng đối với hấp thụ vật lý và hấp thụ hóa học bằng nhau.
Khi hấp thụ hóa học:
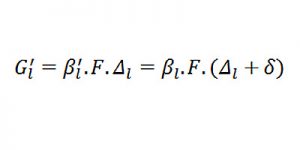
– Hệ số gia tốc hấp thụ trong pha lỏng khi hấp thụ hóa học là:
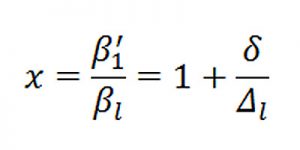
– Quan hệ giữa hệ số truyền khối k’ với hệ số cấp khối 𝛽’ khi hấp thụ hóa học là:
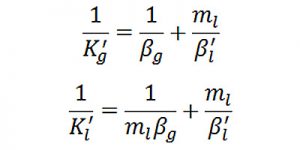
Lưu ý:
Dấu phẩy (‘) ở các ký hiệu là biểu thị có quá trình hấp thụ hóa học (có kèm theo phản ứng hóa học)
Δl: động lực của sự hấp thụ;
ml : hằng số cân bằng pha đối với hấp thụ vật lý với sự hiệu chỉnh lực ion của dung dịch;
δ : độ tăng trưởng động lực hấp thu trong pha lỏng khi có sự hấp thu hóa học.
Hệ số gia tốc hấp thụ phụ thuộc vào vận tốc phản ứng hóa học và mức độ khuấy đảo của chất lỏng. Phản ứng hóa học không thuận nghịch trong pha lỏng sẽ làm triệt tiêu giá trị áp suất riêng phần cân bằng của khí hòa tan trong một khoảng rộng nồng độ.
Trong trường hợp phản ứng không thuận nghịch nhanh giữa khí hòa tan với tác chất tan trong pha lỏng (hay với pha lỏng như là một tác chất) thì m có giá trị không lớn lắm.
Trở lực tương đối của các pha khí và pha lỏng trong sự khuếch tán khi hấp thụ hóa học là hàm số không chỉ của hệ số khuếch tán của khí hòa tan trong các pha lỏng và pha khí, độ hòa tan của khí và thời gian tiếp xúc pha mà còn phụ thuộc nồng độ các chất chưa tham gia phản ứng, vận tốc khuếch tán của tác chất trong pha lỏng và vận tốc phản ứng.
Trên đây là cách tính toán xử lý khí thải bằng phương pháp hấp thụ. Để được tư vấn chi tiết về xử lý khí thải và cách tính toán xử xử lý khí thải bằng phương pháp hấp thụ, tiết kiệm chi phí hãy liên hệ ngay với ETH để được hỗ trợ trực tiếp nhé. Mọi thông tin liên hệ:
———————————-
CÔNG TY CỔ PHẦN MÔI TRƯỜNG ETH
Địa chỉ VPGD: số 25, Phố Nghĩa Đô, Phường Nghĩa Đô, Quận Cầu Giấy, Tp. Hà Nội.
Hotline: 0966.281.336 – 0899.812.999
Website: moitruongeth.com
Email: moitruongeth@gmail.com
